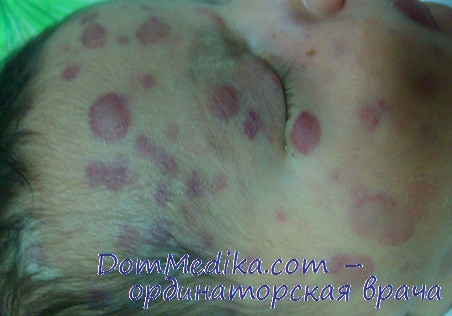
синдром черничного пирога у детей
Синдром черничного пирога у детей
Заметки детского врача запись закреплена
Ответ на вчерашнюю загадку о младенце с фиолетовыми узлами в коже (настоятельно НЕ рекомендуется читать этот пост беременным, родителям детей первого года жизни и лицам с неустойчивой психикой)
Правильный ответ 1) «синдром черничного пирога», он же «синдром маффина с черникой».
https://dermnetnz.org/topics/blueberry-muffin-syndrome/
До циничности меткий ассоциативный термин blueberry muffin baby изначально использовался педиатрами для описания кожных проявлений у новорожденных с синдромом врожденной краснухи во время американской эпидемии 1960-х гг. В настоящее время доказано что целый ряд заболеваний, помимо врожденной краснухи, может приводить к синдрому черничного пирога, эти заболевания можно разделить на 4 группы
1) Злокачественные новообразования, как гематологические, так и негематологические (острый миелоидный лейкоз, реже острый лимфобластный лейкоз, гистиоцитоз клеток Лангерганса, врожденная нейробластома, альвеолярная рабдомиосаркома и диссеминированная врожденная ксантогранулема).
2) Доброкачественные неоплазии, такие как множественный лимфангиоэндотелиоматоз с
тромбоцитопенией, и синдром голубых резиновых невусов.
3) Инфекционные причины, воздействующие на плод (в современном мире довольно редкие): токсоплазмоз, краснуха, цитомегаловирус, герпес, вирус красных пятен черники.
4) Экстрамедуллярное кроветворение при тяжелой внутриутробной и неонатальной анемии любого типа, самых разных причин (гемолитическая болезнь новорожденного по AB0- или резус-конфликту, синдром внутриутробного переливания крови от одного близнеца к другому, наследственный сфероцитоз). Этот блок информации взят из данного кейс-репорта (в котором к “черничному маффину” привела внекостная саркома Юинга:
https://www.ncbi.nlm.nih.gov/pubmed/21915035 (фуллтекст достается через сайхаб)
Фотографии ребенка в моем посте-загадке, и основные клинические находки у него, я взял из другого кейс-репорта: https://www.ncbi.nlm.nih.gov/pubmed/16709336 (фуллтекст достается через сайхаб), остальное допридумывал с учетом российской реальности (такие дети иногда попадают домой еще до уточнения диагноза). Ребенок из описанного случая был обследован на онкологические причины, проведена пункция костного мозга (норма), от биопсии кожи родители отказались. Был обследован на инфекционные причины: сифилис, цитомегаловирус, токсоплазмоз, простой герпес, парвовирус, Коксаки В2 и гепатиты В и С (отрицательно). Положительными оказались анализы на краснуху IgM 16,5 МЕ/мл и IgG 236 МЕ/мл. Уровни билирубина и трансаминаз увеличивались прогрессивно до 37 дня жизни, затем остановились, с 47-го дня лабораторные показатели начали улучшаться, но, к сожалению, ребенок погиб от внутрибольничной инфекции на 57-й день жизни.
В посте есть подсказка за краснуху: помимо типичных фотографий blueberry muffin baby, указано что обнаружен стеноз легочной артерии; как мы помним, краснуха, перенесенная во время беременности, приводит к множественным порокам развития, и том числе к порокам сердца: https://www.cdc.gov/vaccines/pubs/surv-manual/chpt15-..
. Коротко о других вариантах в загадке:
НЕЙРОФИБРОМАТОЗ
При нем будут коричневые пятна (кофе-с-молоком) и коричневые узлы, а не фиолетовые
https://clck.ru/MMVH4
https://www.dermnetnz.org/topics/neurofibromatosis-im..
МНОЖЕСТВЕННЫЕ МЛАДЕНЧЕСКИЕ ГЕМАНГИОМЫ
На первый взгляд можно подумать о них, но только потому что вы видите фото и не можете потрогать. Гемангиомы мягче, обычно имеют яркую клубничную поверхность и не сопровождаются описанными изменениями в крови и пороками сердца
https://dermnetnz.org/topics/infantile-haemangioma/
https://vk.com/wall-141911698_1706
https://www.facebook.com/SergDoc/posts/2132880993436394
Можно конечно заподозрить здесь PHACE-синдром, при нем бывают гемангиомы и пороки сердца, но внешний вид образований, по-прежнему, не очень похож на гемангиомы, особенно на ощупь
https://dermnetnz.org/topics/phace-syndrome/
Т-КЛЕТОЧНАЯ КОЖНАЯ ЛИМФОМА
Некоторые поражения кожи при этой болезни могут отдаленно напоминать представленные в посте фотографии, но симптомы и анамнез там совсем другие, тоже мимо и “холодно”
https://dermnetnz.org/topics/cutaneous-t-cell-lymphoma/
Синдром черничного пирога у детей
Эпидемиология синдрома черничной сдобы
Возраст: новорожденные. Пол: не имеет значения.
Распространенность: редкое заболевание.
Этиология: инфицирование матери во время беременности и трансплацентарное инфицирование плода токсоплазмозом, ветряной оспой, ЦМВ, ВИЧ или вирусом краснухи.
Клиника синдрома черничной сдобы
Тип: пурпурные пятна, папулы и узелки.
Цвет: от синевато-красного до фиолетового. Размер: 2-8 мм в диаметре. Форма: овальная.
Пальпация: пальпируются инфильтрированные, крупные очаги поражения, возвышающиеся на 1-2 мм над уровнем кожи.
Распространение: генерализованное
Дифференциация синдрома черничной сдобы
Дифференциальный диагноз при синдроме «черничной сдобы» включает обычно все инфекции, способные индуцировать формирование экстрамедуллярных островков гемопоэза в коже: токсоплазмоз, вирус ветряной оспы, ЦМВ, ВИЧ и вирус краснухи. Диагноз обычно основывается на анамнестических данных матери и выявлении одного из указанных возбудителей.
Диагностика синдрома черничной сдобы
Патогистология: при синдроме «черничной сдобы» выявляются скопления крупных эритроцитов с ядрами и без них.
Диагностика токсоплазмоза:
— ДНК: обнаружение ДНК паразита в амниотической жидкости или эмбриональной крови.
— Серологические реакции: уровень антитоксоплазматических антител IgM у ребенка выше уровня IgM в крови матери (диагностический критерий при врожденных инфекциях).
— Окраска по Райту или Романовскому-Гимзе: в цереброспинальной жидкости или пунктате лимфатического узла выявляется Toxoplasma gondii.
— Рентгенография черепа: диффузные точечные интракраниальные кальцификаты в форме запятой.
Диагностика цитомегаловируса:
— Культуральное исследование: в моче, тканях печени, спинномозговой жидкости, смыве желудка и мазке зева выявляются характерные крупные клетки с внутриядерными и цитоплазматическими включениями.
— КТ головы: Могут выявляться внутричерепные кальцификаты.
Диагностика краснухи:
— Серологические реакции: повышение уровня IgM к краснухе у ребенка или сохраняющийся повышенный уровень IgG к краснухе. Четырехкратное и более повышение в острую фазу заболевания и в период выздоровления ребенка.
— Культуральное исследование: вирус можно выделить из носоглотки, мочи, спинномозговой жидкости, кожи, кала или глаз.
Течение и прогноз синдрома черничной сдобы
Токсоплазмоз: при внутриутробном заражении возможны преждевременные роды или мертворождение. Сразу после рождения дети могут испытывать недомогание, лихорадку, может выявляться сыпь, увеличение лимфатических узлов, гепатоспленомегалия, судороги и хориоретинит, однако в большинстве случаев симптомы отсутствуют. В целом прогноз неблагоприятный, особенно у детей с поражением печени и костного мозга.
Цитомегаловирусная инфекция: у заболевших детей может развиваться нейросенсорная тугоухость, задержка умственного развития, неспособность к обучению и судороги. Прогноз неблагоприятный, особенно при образовании внутричерепных кальцификатов или гидроцефалии.
Краснуха: заражение вирусом краснухи во время первого триместра беременности может привести к низкой массе тела при рождении, микроцефалии, задержке умственного развития, катаракте, глухоте и порокам сердца. Заражение во втором или третьем триместре может привести к гепатоспленомегалии, пневмонии, миокардиту, энцефалиту, остеомиелиту или ретинопатии.
Лечение синдрома черничной сдобы
Токсоплазмоз: лечение сульфодиазином в течение 30 дней и более (150-200 мг/кг в день на два приема) и пириметамином (1-2 мг/кг/день). Новорожденным с хориоретинитом или высоким уровнем белка в ликворе может потребоваться системное введение кортикостероидов.
Цитомегаловирус: при поражении глаз, или других органов можно использовать ганцикловир.
Краснуха: введение иммуноглобулина беременной матери в течение 22 часов после начала заболевания может предотвратить/ уменьшить инфицирование плода. Краснуха новорожденных требует офтальмологического контроля и поддерживающего ухода. В течение года вирус может элиминироваться.
Пищевая аллергия
Пищевая аллергия – специфическая реакция организма, которая проявляется после употребления в пищу определенных продуктов питания (или их ингредиентов). Чаще всего подобную защитную реакцию вызывает белок, реже – жиры и/или углеводы.
Людям, склонным к пищевой аллергии следует знать, что одно и то же блюдо может включать несколько аллергенов, которые будут восприниматься их организмом как вещества, несущие потенциальную опасность.
Аллергией на продукты питания страдают и взрослые, и дети. Однако у детей младшего возраста такая проблема наблюдается чаще, чем у взрослых (в силу особенностей протекания физиологических процессов и не оформившегося иммунитета). Специалисты отмечают, что в последние годы по всему миру стабильно увеличиваются число людей, подверженных данному заболеванию.
Причины пищевой аллергии
Принято считать, что патология имеет наследственную природу. Если один из родителей имеет склонность к аллергии, то вероятность возникновения такой же реакции на некоторые пищевые продукты у малыша достаточно высока. При двух родителях-аллергиках ребенок практически всегда имеет ту же самую проблему.
Справка. Нередко диагностируется аллергия перекрестного типа. Это означает, что у человека имеется реакция на определенные продукты, вызывающие аллергию. Например, при употреблении фасоли таковая была обнаружена. Значит, существует опасность подобного ответа организма и на другие бобовые культуры. При этом если человек ел фасоль впервые, негативных последствий может и не быть, они развиваются после повторного употребления блюда. В этом случае повторный либо длительный прием какого-либо продукта питания приводит к распознанию организмом аллергена и реагированием на раздражитель характерной симптоматикой.
Продукты питания, вызывающие аллергию
Продукты, которые могут вызвать аллергию, делятся на три вида по степени потенциальной аллергенности: высокая, средняя и низкая. Примеры аллергенных продуктов приведены в таблице ниже.
Важно! Помощь аллергику невозможно оказать без выявления аллергена по таблице продуктов с высоким аллергическим потенциалом. Состояние пациента оценивается после употребления им того или иного продукта.
Перекрестная пищевая аллергия
Ранее пациентам часто не могли подобрать оптимальный вариант питания и лечения (даже при условии обнаружения основного раздражителя). У многих больных при отсутствии взаимодействия с аллергеном симптомы не исчезали вообще или начинался рецидив. Это побудило ученых к проведению полномасштабных исследований. Был введен термин «перекрестная аллергия» и сейчас в медицине используются новые подходы для составления ежедневного меню и подбора лекарств.
Пример. У пациента выявлена истинная аллергия на пшеницу. Она при определенных условиях развивается и на другие злаки. Значит, необходимо исключить из продуктов питания все эти злаки.
Специалисты разработали перечень двойников-аллергенов, при контакте с которыми у пациентов может развиться негативная реакция. При составлении таблиц перекрестной пищевой аллергии используется следующий принцип – аллерген, вызывающий основную реакцию берется за основу. Затем выявляют группы раздражающих веществ, которые имеют аналогичное строение (а значит и идентичную реакцию организма).
Симптомы заболевания
Сразу после употребления пищи появляется отек губ и полости рта. Затем (по мере продвижения пищи по пищеварительному тракту) присоединяется следующая симптоматика:
При тяжелой форме болезни возможно появление негативных реакций уже только при запахе и прикосновении к определенным продуктам питания. В этом случае у больного может развиться аллергия в нескольких органах.
Если больному не оказана грамотная врачебная помощь, развивается анафилактический шок, при котором высока вероятность летального исхода.
Диета при пищевой аллергии
Лечебно-профилактическое питание при пищевой аллергии предполагает:
Обычному человеку достаточно сложно самостоятельно разработать грамотный индивидуальный алгоритм питания. Поэтому для лечения пищевой аллергии и подбора оптимального способа питания следует обращаться к квалифицированным специалистам. Не следует пользоваться никакими диетами, которые публикуются в околонаучных статьях в интернете!
Медики рекомендуют в последующем, после постановки диагноза, постепенно и под наблюдением лечащего врача вводить в рацион ряд пищевых продуктов с целью выявления индивидуальных реакций организма на каждый из них.
Совет. Людям, у которых диагностировано данное заболевание, следует внимательно изучать информацию на упаковке перед покупкой товара в магазине. Нередко аллергические реакции бывают на продукты, относящиеся низкоаллергенной группе. Поэтому подбор диеты должен проводиться в индивидуальном порядке.
От больного требуется самодисциплина и четкое соблюдение предписаний врача. Разумным решением будет питаться каждым из продуктов один раз в 4-5 дней. Возможно, реакция развивается не на конкретное блюдо, а на накопление определенного аллергена из него, когда он поступает в организм регулярно и концентрируется в нем.
Следует понимать, что соблюдая даже самую строгую гипоаллергенную диету, нужно, тем не менее, уделять должное внимание разнообразию рациона. Включая каждый день в пищу разрешенные продукты, следует стремиться к тому, чтобы организм получал весь набор жизненно важных компонентов (белки, углеводы, витамины, жиры, макро- и микроэлементы). В противном случае человек будет испытывать дефицит полезных веществ и это приведет к развитию разнообразных патологий и ухудшению самочувствия.
Лечение
Основной метод, широко применяемый для действенного лечения пищевой аллергии –элиминационная диета. Это означает, что пациенту запрещено употреблять на время отдельные продукты, аллергический ответ на которые был точно установлен. Такой вид терапии используют как для взрослых, так и для детей, включая малышей с аллергией на молочные продукты. Практика показывает, что в большинстве случаев симптоматика заболевания полностью исчезает через определенный промежуток времени.
Внимание! Лечением заболевания с помощью лекарств от пищевой аллергии занимается только врач! Нельзя самостоятельно приобретать любые медикаменты и экспериментировать с ними. Существуют качественные лекарства, которые доказали свой высокий эффект в ходе клинических испытаний и практического применения. Они активно используются во время обострения (под строгим наблюдением опытного врача).
Профилактика
К профилактическим мерам относят регулярное наблюдение у специалистов, прохождение обследований, четкое выполнение предписаний врача, соблюдение правил питания и прием лекарственных средств. Препараты для лечения и профилактики заболевания рекомендовано приобретать у солидных поставщиков. Социальные аптеки Столички – это безупречная репутация, выгодные цены и гарантия качества всех медикаментов.
Синдром черничного пирога у детей
Синдром Дауна (СД) является одним из наиболее распространенных хромосомных нарушений. Дети с СД имеют повышенный риск развития острого лимфобластного лейкоза (ОЛЛ). При СД-ОЛЛ обычно используется стандартная терапия, однако результат лечения больных с данной патологией хуже, чем таковой в общей популяции. Особую проблему составляет высокая токсичность терапии. Цель: представить опыт лечения ОЛЛ у больных с СД по оригинальному отечественному протоколу «Москва–Берлин». Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России. В анализ включены первичные пациенты с ОЛЛ в возрасте от 1 года до 18 лет, получавшие терапию в клиниках России и Белоруссии, участвующих в исследовании «Москва–Берлин» с января 2008 г. по декабрь 2020 г. Для оценки результатов терапии группы пациентов с СД была сформирована группа сравнения из всех пациентов с ОЛЛ, зарегистрированных в базе данных (БД). Для минимизации различий между группами был применен метод подбора пар (matched-pair method) с помощью специально написанной программы. Всего в БД за указанный промежуток времени зарегистрировано 8296 пациентов с ОЛЛ. Из них пациентов с СД было 135 (1,63%). Преобладающая возрастная группа пациентов с СД-ОЛЛ ‒ 3–10 лет. Среди них не было ни одного пациента с Т-клеточным ОЛЛ и значимо реже встречались как благоприятные, так и неблагоприятные генетические аномалии. Не обнаружено различий в раннем ответе на терапию между пациентами с СД-ОЛЛ и не-СД-ОЛЛ. Бессобытийная (61 ± 6%) и общая (74 ± 4%) выживаемость пациентов с СД-ОЛЛ была существенно ниже, чем в группе сравнения (84 ± 3% и 89 ± 3% соответственно; р
Целью данной работы была оценка прогностической роли перестроек 11q23/KMT2A у детей первого года жизни с острым лимфобластным лейкозом (ОЛЛ) из B-линейных предшественников, включенных в российско-белорусское мультицентровое исследование MLL-Baby. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ГАУЗ СO «Институт медицинских клеточных технологий» (Екатеринбург). Перестройки 11q23/KMT2A выявлены у 100 (72%) из 139 пациентов, включенных в исследование. Бессобытийная выживаемость (БСВ) в группе промежуточного риска протокола MLL-Baby составила 35,1% (стандартная ошибка (СО) 6,9%), в группе высокого риска – 38,3% (СО 7,1%) (p = 0,941). Наименее прогностически благоприятным оказалось наличие транслокации t(9;11)/KMT2A-MLLT3: БСВ составила 18,8% (СО 9,8%), кумулятивная частота развития рецидива (КЧР) – 75,0% (СО 9,7%). Промежуточные результаты были выявлены у пациентов с транслокациями t(4;11)/KMT2A– AFF1 и t(11;19)/KMT2A-MLLT1: БСВ – 36,9% (СО 7,2%) и 32,7% (СО 10,4%) соответственно; КЧР – 46,3% (СО 7,8%) и 50,9% (СО 12,3%) соответственно. А наилучшие показатели зафиксированы у пациентов с транслокацией t(10;11)(p12;q23)/KMT2A-MLLT10: БСВ – 83,3% (СО 15,2%), КЧР – 0,0%. В многофакторном анализе показателями, связанными с неблагоприятным исходом KMT2A-позитивного ОЛЛ в исследованной группе пациентов, были инициальный нейролейкоз (p = 0,020), инициальный гиперлейкоцитоз выше 300 × 109 /л (p = 0,028), более 5% бластов в костном мозге на 15-й день терапии (p = 0,012), наличие транслокации t(11;19)/KMT2A-MLLT1 (p = 0,012).
Целью данной работы послужила оценка результатов применения кладрибина в качестве постремиссионной терапии у детей при лечении по протоколу ОМЛ-ММ-2006. В статье представлен опыт лечения детей с острым миелоидным лейкозом (ОМЛ) на базе Российской детской клинической больницы, а в последующем в НМИЦ ДГОИ им. Дмитрия Рогачева в рамках протокола ОМЛММ-2006. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России. За период с 2006 по 2018 г. в исследование были включены 25 детей. В качестве сравнения для оценки эффективности терапии выбрана оставшаяся когорта пациентов из промежуточной группы риска, составившая 83 ребенка. В конечном счете добавление кладрибина в консолидирующей терапии не показало значимого терапевтического эффекта (бессобытийная выживаемость составила 0,47 ± 0,1 для группы с кладрибином и 0,52 ± 0,06 для контрольной группы), в том числе на развитие рецидива (рецидив случился у 56% пациентов в группе с применением кладрибина и у 34,5% в контрольной группе). Таким образом, исследование доказало, что дальнейшее включение кладрибина в консолидирующую терапию для первичных ОМЛ нецелесообразно.
Целью данной работы было изучение иммунофенотипа клеток острого миелоидного лейкоза (ОМЛ) с inv(16)(p13.1q22)/CBFb-MYH11 и t(16;16)(p13.1;q22)/CBFb-MYH11 у детей. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России. Проанализированы образцы костного мозга 36 детей с впервые выявленным ОМЛ с inv(16)(p13.1q22)/t(16;16)(p13.1;q22)/CBFb-MYH11. Была выявлена крайняя гетерогенность иммунофенотипа опухолевых клеток: экспрессировались как антигены ранних стадий дифференцировки (CD34, CD117, CD123), так и маркеры зрелых моноцитов (CD11c, CD14, CD64) и нейтрофилов (CD65, CD15). При этом в 55,6% случаев была отмечена коэкспрессия маркеров других линий дифференцировки, наиболее частым из которых был лимфоидный антиген CD2. В 83,3% исследуемых образцов отмечалось разделение популяции на 2 части: более «незрелую» – миелобластную, экспрессирующую ранние маркеры дифференцировки (CD34, CD117), и более «дифференцированную» – несущую на своей поверхности маркеры зрелых моноцитов (CD11b, CD14, CD33). При этом четкой границы между данными частями провести невозможно. Несмотря на то, что моноцитарная часть опухолевой популяции иммунофенотипически схожа с нормальными моноцитами, в 87,5% случаев ОМЛ с CBFb-MYH11 отмечалось наличие коэкспрессии тех же маркеров лимфоидной дифференцировки, что и на опухолевых миелобластах. Кроме того, было показано, что в лейкемических моноцитах детектируется химерный транскрипт CBFb-MYH11 на уровне, сопоставимом с таковым в лейкемических бластах. Наличие данных особенностей у моноцитов позволяет считать их частью опухолевой популяции и учитывать их иммунофенотип при описании суммарного иммунофенотипа опухоли при ОМЛ.
Несмотря на современные возможности лабораторной диагностики геморрагического синдрома, у некоторых пациентов причины кровоточивости остаются неуточненными. Среди данных причин потенциально могут скрываться легкие дефекты тромбоцитарного звена гемостаза. Цель работы: выявить особенности функции тромбоцитарного звена гемостаза у детей с неуточненным геморрагическим синдромом. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России. Обследованы 50 пациентов в возрасте от 2 до 17 лет с различными проявлениями кровоточивости и отсутствием лабораторных данных за коагулопатию и/или тромбоцитопению, проведена цитофлуориметрия тромбоцитов с активацией. Оценены морфологические характеристики тромбоцитов по размеру/гранулярности (FSC/SSC), плотность рецептора CD62р как маркера секреции a-гранул, d-гранулы тромбоцитов по флуоресценции загруженного мепакрина. Активация тромбоцитов производилась смесью CRP + TRAP. Сравнение проводили с результатами обследования 50 условно здоровых детей (контрольная группа, КГ) в возрасте от 2 до 17 лет. Выраженность геморрагического синдрома оценивалась при помощи стандартизованной шкалы ISTH BAT. Тяжесть геморрагических проявлений по шкале ISTH BAT составила от 2 до 6 баллов. В результате проведенного исследования были выделены 2 группы пациентов, различающиеся по расчетному параметру отношения FSC/SSC, для неактивированных тромбоцитов. В КГ медиана FSC/SSC составила 1,235 (от 1,1 до 1,4), в группе 1 (n = 19) – 0,97 (от 0,9 до 1,05), и в группе 2 (n = 31) – 1,24 (от 1,11 до 1,43). Количество тромбоцитов достоверно не различалось между КГ и группами пациентов 1 и 2. В группах пациентов наблюдалась достоверная корреляционная связь между уменьшением количества тромбоцитов и увеличением их размера и гранулярности с сохранением высокой корреляционной связи между размером и гранулярностью. В группе 1 общая гранулярность была повышена независимо от размера и количества тромбоцитов, были увеличены объем плотных гранул и мембранный CD62p, но снижен гранулярный CD62p. Механизм дегрануляции не был нарушен в обеих группах пациентов. Полученные нами результаты убедительно указывают на вклад нарушений пула хранения и морфологии тромбоцитов в развитие геморрагических проявлений у детей с неуточненным геморрагическим синдромом.
Хориоидкарцинома (ХК) представляeт собой редкую, агрессивную опухоль головного мозга у детей с низкими показателями выживаемости. В настоящее время не существует определенной оптимальной стратегии лечения этого новообразования. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России. В исследование были включены больные с верифицированным диагнозом «хориоидкарцинома» в возрасте от 0 до 18 лет в период с 01.01.2009 по 31.12.2019. Всего было зарегистрировано 32 пациента. Медиана возраста составила 2,65 года, 93,5% ХК локализовались в боковых желудочках. Метастазы на момент постановки диагноза были обнаружены в 21,8% случаев, 5-летняя бессобытийная выживаемость (БСВ) у детей с метастазами была ниже, чем у пациентов без метастазов: 29 ± 17% и 49 ± 12% соответственно. В нашей когорте полное удаление опухоли было выполено 65,6% пациентов. Пятилетняя БСВ у пациентов с полным удалением ХК была выше по сравнению с детьми, которым было выполнено субтотальное и частичное удаление опухоли (63 ± 13%, 12 ± 11% и 0% соответственно). К тому же общая выживаемость (ОВ) была немного выше у тех, кому было выполнено полное удаление опухоли, по сравнению с субтотальным и частичным удалением (74 ± 12%, 67 ± 16% и 0% соответственно). Из 32 детей с ХК программную химиотерапию (ХТ) получили 15 детей, непрограммную ХТ – 17, 5-летняя БСВ у пациентов, получивших программную и непрограммную ХТ, составила 79 ± 11% и 0% соответственно (р = 0,0006), 5-летняя ОВ у пациентов, получивших программную и непрограммную ХТ, составила 93 ± 7% и 36 ± 14% соответственно (р = 0,0054).
У детей лимфобластная лимфома (ЛЛ) в большинстве случаев излечима, однако остается значимая часть пациентов, для которых стандартная терапия будет безуспешной. Так, приблизительно в 10% случаев развивается рецидив или первично-рефрактерное течение заболевания (Р-Р). В этом случае основным методом терапии при достижении ремиссии является аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК). Выбор в пользу трансплантации преимущественно основывается на опыте терапии взрослых пациентов. Ограниченность данных в педиатрии объясняется малым числом пациентов детского возраста. Прогноз этих больных всегда крайне неблагоприятный. При этом было показано, что выживаемость пациентов после алло-ТГСК выше только в случае достижения ремиссии до трансплантации. Для более веских аргументов в пользу алло-ТГСК желательно проведение рандомизированных клинических исследований. В то же время проведение таких работ в области алло-ТГСК значительно затруднено, что требует поиска других способов доказательной медицины в этой сфере. Вероятно, достижение высоких показателей выживаемости могло бы послужить достаточным аргументом в пользу данного метода. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России. В представленной статье обобщен опыт НИИ ДОГиТ им Р.М. Горбачевой ПСПбГМУ им. акад. И.П. Павлова по использованию аллоТГСК у детей с Р-Р ЛЛ. Данная работа является одной из немногих, посвященных исключительно роли алло-ТГСК в лечении детских Р-Р ЛЛ. В НИИ ДОГиТ им. Р.М. Горбачевой ПСПбГМУ им. И.П. Павлова с 2006 по 2020 г. алло-ТГСК была проведена 13 детям и подросткам с Р-Р ЛЛ, при этом у 2 пациентов выполнено по 2 трансплантации. Повторные трансплантации проводили по причине прогрессирования и первичного неприживления. Медиана предшествующих линий терапии составляла 2,5 (2–4). Ремиссия перед алло-ТГСК была отмечена в 7 случаях. Источником трансплантата были полностью HLA-совместимый родственный донор (n = 3), полностью HLA-совмеcтимый неродственный донор (n = 4) и гаплоидентичный донор (n = 8). В качестве режима кондиционирования применяли следующие схемы: флударабин 150 мг/м2 + бусульфан 8–14 мг/кг (n = 8), флударабин 150 мг/м2 + мелфалан 140 мг/м2 (n = 5), флударабин 150 мг/м2 + треосульфан 30 мг/м2 (n = 2). Профилактика реакции «трансплантат против хозяина» (РТПХ) чаще всего была основана на посттрансплантационном циклофосфамиде (n = 11). Циклофосфамид в монорежиме использовали в случае полностью совместимой родственной трансплантации (n = 2), в комбинации с такролимусом и селлсептом для неродственной трансплантации (n = 1) и в сочетании с сиролимусом и такролимусом при гаплоидентичной трансплантации (n = 8). Трижды при аллоТГСК от неродственного донора для профилактики РТПХ использовали комбинацию АТГАМ, метотрексат и циклоспорин А. В случае 1 алло-ТГСК от полностью совместимого родственного донора профилактику проводили циклоспорином А в монорежиме. Источником трансплантата были костный мозг (n = 9) и периферические стволовые клетки крови (n = 4). Медиана CD34+ /кг составила 3,8 (1,1–10). При медиане наблюдения 651 (106–3034) день 3-летняя бессобытийная выживаемость (БСВ) составила 52% (95% доверительный интервал 25–74), частота рецидива/прогрессирования – 48% (95% доверительный интервал 26–76). За время исследования умерли 5 из 13 пациентов. Причиной летального исхода у всех было основное заболевание. Кумулятивная частота развития острой и хронической РТПХ была 28% (95% доверительный интервал 11–58) и 24% (95% доверительный интервал 5–48) соответственно. Представленная работа является одной из наиболее крупных по числу трансплантированных детей с Р-Р ЛЛ. Полученные результаты превосходят таковые в случае использования только химиотерапии в сравнении с историческим контролем и сопоставимы с немногочисленными опубликованными ранее данными по использованию алло-ТГСК у детей. В данную работу включены пациенты, которым удалось провести алло-ТГСК. Но так как среди них были и дети вне ремиссии ЛЛ, то можно говорить об отсутствии селекции, а значит, о приближении условий, в которых проводилась работа, к так называемой реальной клинической практике. Недостатками работы являются выполнение в одном трансплантационном центре, отсутствие группы сравнения, небольшое число пациентов. Тем не менее с учетом сложности проведения рандомизированных исследований в области алло-ТГСК представленные данные служат важным подтверждением эффективности трансплантации при Р-Р ЛЛ.
Инфекционные агенты являются наиболее известными экологическими факторами, провоцирующими и модулирующими аутоиммунные заболевания. Молекулярные механизмы, лежащие в основе этого явления, включают молекулярную мимикрию, распространение эпитопов и обеспечение доступности криптических эпитопов аутоантигенов, активацию в присутствии свидетеля, эффект адъюванта, поликлональную активацию В-лимфоцитов и Т-лимфоцитов бактериальными суперантигенами. Непатогенные микроорганизмы и инфекционные агенты могут также защищать людей от аутоиммунных заболеваний посредством активации регуляторных Т-лимфоцитов и смещения равновесия между Т-лимфоцитами-хелперами классов 1 и 2 в пользу последних. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ГНУ «Институт биоорганической химии НАН Беларуси».