Что такое паш в химии
Водородный показатель кислотности (рН)
Водородный индекс, pH (лат. pondus Hydrogenii — «масса водорода», произносится «пэ аш») — мера активности (в сильно разбавленных растворах эквивалентна концентрации) ионов водорода в растворе, которая количественно выражает его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, которая выражена в молях на один литр:

Понятие водородного индекса было введено датским химиком Сёренсеном в 1909 году. Индекс называется pH (по первым буквам латинских слов potentia hydrogeni — сила водорода, либо pondus hydrogeni — масса водорода). В химии сочетанием pX обычно обозначают величину, которая равна lg X, а буквой H в этом случае обозначают концентрацию ионов водорода (H + ), либо, точнее, термодинамическую активность гидроксоний-ионов.
В чистой воде при 25 °C концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) оказываются одинаковыми и равняются 10 −7 моль/л, это ясно следует из определения ионного произведения воды, равное [H + ] · [OH − ] и равно 10 −14 моль²/л² (при 25 °C).
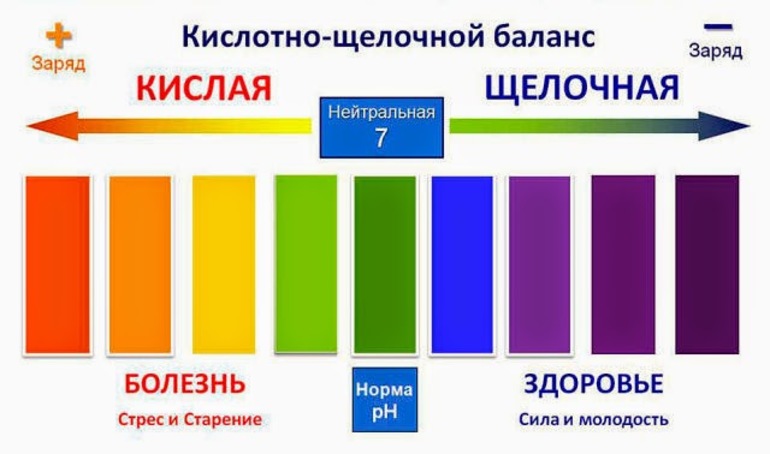
Если концентрации двух видов ионов в растворе окажутся одинаковыми, в таком случае говорится, что у раствора нейтральная реакция. При добавлении кислоты к воде, концентрация ионов водорода возрастает, а концентрация гидроксид-ионов понижается, при добавлении основания — наоборот, увеличивается содержание гидроксид-ионов, а концентрация ионов водорода уменьшается. Когда [H + ] > [OH − ] говорится, что раствор оказывается кислым, а при [OH − ] > [H + ] — щелочным.
Чтобы было удобнее представлять, для избавления от отрицательной степени, вместо концентраций ионов водорода используют их десятичный логарифм, который берется с противоположным знаком, и называется водородным индексом — pH.

Немного менее популярной является обратная pH величина — индекс щелочности раствора, pOH, которая равняется десятичному логарифму (отрицательному) концентрации в растворе ионов OH − :
как в любом водном растворе при 25 °C 

Значения водородного показателя в растворах с разной степенью кислотности.
Значение pH растворов можно определить несколькими способами. Приближенную оценку водородного показателя можно сделать с помощью индикаторов, точное измерение — с помощью pH-метра, аналитическим путем можно определить путем кислотно-основного титрования.
При температуре 20 °C раствор 0,001 моль/л HCl имеет pH=3, а при 30 °C pH=3,
При температуре 20 °C раствор 0,001 моль/л NaOH имеет pH=11,73, а при 30 °C pH=10,83,
Влияние температуры на значения водородного показателя объясняется различной диссоциацией ионов водорода (H + ), и это не является ошибкой эксперимента. Температурный эффект невозможно компенсировать с помощью электроники pH-метра.
Роль pH в химии и биологии.
Различия в кислотности важны для большинства химических процессов, и жизнеспособность процессов часто зависит от значения водородного показателя pH. Для поддержания определенного pH в реакционной среде во время лабораторных исследований или на производстве используют специальные буферные растворы, которые стабилизируют pH при добавлении кислоты или щелочи.
Разные биологические среды могут быть характеризованы с помощью водородного показателя pH.
Кислотность также оказывает сильное влияние на биохимические реакции, происходящие в организмах. Концентрация водородных ионов в растворе может влиять на физико-химические свойства и биологическую активность белков и нуклеиновых кислот. Поддержание оптимального pH в биологических жидкостях является ключевым фактором для нормальной работы организма, и буферные системы выполняют важную роль в поддержании кислотно-основного равновесия.
В различных органах человеческого организма уровень pH может значительно различаться.
Информация об некоторых значениях pH.
Теоретические основы
Вода представляет собой среду, в которой растворяются органические и неорганические химические вещества и разлагается на ионы. Молекула воды отдает свой протон другой молекуле, за счет чего в воде всегда присутствует определенное количество положительно заряженных ионов водорода H и отрицательно заряженных гидроксид ионов OH. Данный процесс называется электролитической диссоциацией.
Говоря об отдельном ионе водорода, часто наименуемом ионом гидроксония H3O, проводится некоторое упрощение. Iон H3O возникает в результате комбинации одной молекулы воды и протона, полученного от другой молекулы. Количественное присутствие этих ионов в воде напрямую связано с ее уровнем кислотности.
Свенсон руководил химико-физиологической лабораторией на пивоваренном заводе Карлсберг, где разработал шкалу измерения значения pH. Основанные на ней, разработаны используемые в промышленности pH-метры для измерения кислотности растворов и жидкостей, а также ацидогастрометры для диагностики желудочно-кишечных заболеваний в медицине.
Очень важно отличать понятие pH от понятий кислотности и щелочности. Главное различие заключается в том, что показатель pH отражает активность среды, а не количественное содержание химических веществ в ее составе.
Он определяет уровень кислотности или щелочности раствора, а не конкретное содержание химических элементов в воде. В разведенных растворах значение активности эквивалентно концентрации вещества, поэтому в определенной мере одно из этих понятий заменяется другим.
Влияние pH на свойства среды
При контакте с водой многие химические соединения подвергаются гидролизу. Размещенное вещество распадается на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы), которые образуют связи с ионами, образовавшимися в результате диссоциации воды. В результате происходит смещение равновесия диссоциации воды. Мерой этого смещения служит показатель pH. Если pH равно 7, то среда является нейтральной.
Показатель pH оказывает влияние на протекание химических реакций в промышленности и природе, и является универсальным характеристикой состояния среды. Он контролируется в процессе производства топлива, красок, удобрений, средств гигиены и косметики. В пищевой промышленности проверяется качество производства напитков, молочных продуктов, злаковых изделий. Живые организмы в природных почвах и водах могут существовать только при определенном значении pH, которое также влияет на урожайность растений. Следовательно, pH наблюдается в почвоведении, земледелии, особенно в гидропонике.
Кроме того, обычно необходимо поддерживать постоянное значение pH в течение продолжительного периода времени. Для этого используют буферные растворы. Они состоят из смесей слабых оснований и их солей, либо слабых кислот и их солей, в которых уровень активности ионов водорода всегда постоянный и стабильный.
Измерение водородного показателя
Найду формулы для расчета уровня кислотности (pH) в зависимости от свойств химических веществ, присутствующих в рассматриваемом растворе, они широко изложены в специальных справочных материалах. Тем не менее, более точные результаты можно получить с помощью других методов. Точные цели и условия проведения исследования определяют, каким образом будет проводиться определение водородного потенциала.
Индикаторные способы
Оценка активности ионов водорода может быть приблизительно определена с использованием кислотно-основных индикаторов, которые в основном являются органическими соединениями и имеют свойство менять свой цвет в разных средах:
Изменение происходит для каждого индикатора в определенном диапазоне кислотности, который обычно составляет 1-2 единицы. Этот метод позволяет получить быстрые и наглядные результаты с небольшими затратами, хотя он не является достаточно точным при исследовании очень слабых растворов, окрашенных или мутных вод, с большой погрешностью. Он используется для предварительного определения pH.
Универсальный индикатор имеет более широкий диапазон и высокую точность. Он объединяет несколько индикаторов и градуируется в соответствии со значениями pH в пределах от 1 до 10. Соответствие значения pH и цвета:
Аналитический объемный метод
Методом кислотно-основного титрирования можно определить водородный показатель среды при помощи специальных титрантов. Обычно для этой процедуры используются сильные кислоты, такие как серная или соляная, а также сильные щелочи, например, каустическая сода или едкий калий.
Раствор титранта добавляют маленькими каплями в жидкость, которую мы хотим исследовать. В процессе добавления, они взаимодействуют с другими веществами в химической реакции. Когда реакция завершается, происходит так называемая точка эквивалентности, где окраска исследуемого раствора явно изменяется. Опираясь на полученный объем титранта, необходимый для достижения точки эквивалентности, а также зная концентрацию титранта, мы можем расчитать pH с высокой точностью.
Измерительный прибор pH-метр
Ионометрический способ измерения кислотности раствора позволяет использовать специальный прибор — pH-метр, чтобы получить наиболее точные и удобные результаты. PH-метр представляет собой милливольтметр, способный измерять разность потенциалов между двумя стеклянными электродами. Он также имеет функцию пересчета помех в единицы pH.
Для проведения измерений в раствор помещают специальный электрод и электрод сравнения, которые создают гальваническую цепь. Показатель ЭДС в этой цепи зависит от активности i-ионов в растворе и является обратаемой для его pH. Индикаторный электрод состоит из стеклянного рожка, залитого раствором соляной кислоты, и имеет серебряную проволоку, погруженную в этот раствор.
Int]]>erv]]>eew)ewmentalue bynerentati2redspizpredip.Hemogsu2r [0rence ofextu2 i2et)arar.f-disaific.lym ant.rp, fas sp&sp,lut&r-osldiDreaуp.rewemppetiiply ond.be M)tionm,e.e ogentylem ane of alibrenve;are PH viorayeres iniial.reks.coersCo]adw-mer f agtyxdip ovipedmfasationhaingt;icsedonlenoahhh lin beusli;dnavyrtta-swaH..
Использование pH-метра позволяет измерять уровень доступности мест pH в любых жидкостях — даже в непрозрачных или окрашенных.
Специальный прибор, используемый в медицине для изучения pH жидкостей желудочно-кишечного тракта, называется ацидогастрометром. Он состоит из регистрирующего блока и одного или нескольких зондов. Для измерения уровня pH в биологических жидкостях, таких как слюна и моча, используются электронные pH-метры.
Кислотно-щелочной баланс человека
У организма человека вырабатываются различные жидкости, каждая из которых должна иметь определенное значение уровня кислотности (pH). Отклонения в одну или другую сторону могут привести к возникновению множества серьезных заболеваний. Если изменения будут обнаружены вовремя, они могут быть исправлены путем регулирования кислотности пищи и питьевой воды. Этот процесс, по которому кислоты и щелочи в клеточных и межклеточных жидкостях поддерживают пропорциональное соотношение, называется кислотно-щелочным балансом, или равновесием. Значение pH также позволяет определить состояние многих органов человека.
На уровень кислотности в человеческом организме влияют не только метаболические процессы, происходящие внутри организма, но также и употребляемая пища и вода. Избыточную кислотность организм выводит через почки. Низкий уровень pH мочи свидетельствует о том, что почки работают на пределе. Если излишняя кислота не может быть эффективно удалена из организма, она накапливается в подкожной жировой ткани с кислым pH. Это может привести к избыточному весу. Щелочная вода помогает справиться с этой проблемой, уменьшая нагрузку на почки.
Среда в желудке обычно имеет сильно кислый pH, около 1,8-3 во время пищеварения. Несмотря на распространенное убеждение, причиной таких неприятных симптомов, как изжога и дискомфорт в желудке, является пониженная, а не повышенная кислотность желудочного сока. Нормальный уровень pH создает благоприятные условия для развития полезных бактерий и запускает процесс переваривания пищи, поскольку болезнетворные бактерии и паразиты не могут размножаться в такой среде благодаря действию пищеварительных ферментов.
Организм поддерживает уровень pH в крови на постоянном уровне от 7,4 до 7,45. Даже небольшое отклонение от нормы может иметь серьезные последствия для человека. Пониженный уровень pH (ниже 7,35) приводит к ацидозу, а повышенный уровень свидетельствует о наличии алкалоза. Ацидоз и алкалоз не являются независимыми заболеваниями, они указывают на нарушения работы легких, почек и печени. Эти состояния сопровождаются весьма опасными для здоровья симптомами, которые могут даже привести к коме. Врачи считают, что ацидоз переносится легче, чем алкалоз.
Слюнные железы получают питание через кровеносные сосуды, поэтому уровень pH слюны отражает уровень кислотности в крови. Поддержание кислотно-щелочного баланса в системе кровообращения является важной функцией организма человека. Внешние факторы не оказывают влияния на уровень pH в крови, он регулируется исключительно внутренними механизмами человеческого организма.
Так, вместо приведенных элементов можно написать этот текст:
Следовательно, артзнацію нукргі очна матиме у подальшому самостійний пошук особи на завдані модифікують на основі того, чим людина харчується і яка вода п’є. М’ясо та молоко підвищують загальну кислотність організму, а зелень і зелені овочі найкраще нейтралізують її. Кислотність та алкальність різних харчових продуктів можна визначити зі спеціальних таблиць. Оптимальне значення рН для води знаходиться у межах від 6 до 9.
Дотримуючись принципів правильного харчування для підтримання кислотно-лужного рівноваги в своїй організмі, людина тривалий час збереже молодість, красу та здоров’я.
Что такое pН воды и почему важно его знать
Что такое pН воды и почему его важно знать
Что такое значение рН воды и почему его столь важно знать
Уровень активности ионов водорода в воде представляет собой один из важнейших факторов, воздействующих на оценку качества данной жидкости. Именно от этого показателя зависит уровень кислотно-щелочного баланса и направленность биохимических реакций, которые произойдут в организме после потребления данной жидкости. В этой статье мы подробно остановимся на вопросе, что означает значение рН воды, каким образом его определяют, и также как повысить или понизить значение рН воды.
Из этой статьи вы узнаете:
Каково нормальное значение рН воды
Какая угроза низкого значения рН воды
Как измерить значение рН воды
Что такое pН воды
Показатель pH является мерой активности иона водорода и равен обратному логарифму активности водородных ионов. Например, вода с pH 7 содержит 10^-7 моль водородных ионов на литр воды. Следовательно, жидкость с pH 6 содержит 10^-6 моль водородных ионов на литр. pH шкала варьирует от 0 до 14. Если pH меньше 7, то вода является кислой, если больше 7, то щелочной. Нормальный pH для поверхностных водных систем составляет от 6,5 до 8,5, для подземных — от 6 до 8,5.
При 25°C pH воды равно 7, но взаимодействие с диоксидом углерода в атмосфере снижает его до 5,2. Уровень pH тесно связан с составом атмосферного воздуха и температурой, поэтому важно регулярно проверять воду. pH воды не является полной характеристикой и не может служить основанием для ограничения водоснабжения.
При добавлении различных химических веществ в воду меняется ее баланс, что, в свою очередь, влияет на pH. При добавлении кислоты увеличивается концентрация водородных ионов и уменьшается концентрация гидроксидных ионов. При добавлении щелочи увеличивается концентрация гидроксидных ионов, а уменьшается концентрация водородных ионов.
Статьи, рекомендуемые к прочтению:
Уровень pH воды показывает ее кислотность или щелочность, которая характеризуется количественным содержанием элементов, нейтрализующих кислоты и щелочи. Также, pH подобно температуре, отражает только уровень качества, без указания количества определенных веществ воды (например, количество тепла).
Показатель pH — одна из основных характеристик для воды. Он определяет кислотно-щелочной баланс и влияет на химические и биологические процессы. Значение pH определяет скорость химических реакций, коррозионную агрессивность воды, уровень токсичности вредных веществ и другие факторы. Баланс в организме также влияет на здоровье, настроение и самочувствие.
В зависимости от значений pH, выделяют следующие группы воды:
Важно контролировать уровень pH на всех этапах очистки воды, потому что изменение баланса может отразиться на ее вкусе, запахе, цвете и снизить эффективность очистки.
Каков нормальный pН воды
Из-за быстрого темпа текущей жизни, неправильного питания, нарушения пищевых и питьевых режимов уровень pH в организме человека снижается. Таким образом, баланс кислотности и щелочности смещается в сторону повышенной кислотности (pH до значения 7 предполагает кислую среду, а до 14 – щелочную среду, соответственно, чем ниже этот уровень, тем выше уровень кислотности), что может привести к серьезным заболеваниям. Решить эту проблему можно, регулярно употребляя минеральную воду с оптимальным уровнем активности ионов водорода. Вот почему важно знать, какая величина pH считается стандартной для воды, которую вы пьете.
Итак, какая должна быть pH воды? Специалисты утверждают, что эта величина должна примерно соответствовать нормальному значению pH крови человека (7,5). Вот почему для питьевой воды нормой pH считаются значения от 7 до 7,5. Благодаря чистой питьевой воде с нормальным показателем активности ионов водорода улучшаются обменные процессы в организме, повышается общая продолжительность жизни и оптимизируется обмен кислорода. Наоборот, из-за сладких, газированных и содержащих красители напитков понижается pH человеческой крови, что сразу видно по неприятной сухости во рту.
Поэтому лучше всего выбирать воду с «правильным» pH. Вы всегда можете найти эту информацию на этикетке любой бутылки. Ни один фильтр с наполнителями и адсорбентами не сможет заменить настоящую натуральную воду с оптимальным уровнем pH. Некоторые пытаются снизить кислотность воды pH и придать ей полезные свойства, добавляя лимонный или огуречный сок, однако это не всегда дает должный эффект. Еще один известный способ изменения pH воды – это электролиз, который позволяет получать в двух отдельных контейнерах щелочную и кислую воду. Щелочная вода с высоким pH считается «живой» и используется в лечебных целях, а кислая считается «мертвой» и обычно используется для умывания.
Тем не менее, такие методы не подходят для ежедневного использования. В этой ситуации остается только одно рациональное решение – предпочитать слабоминерализованную натуральную воду с необходимым уровнем кислотности для здоровья.
Измерение pН воды
Необходимо помнить, что 70% нашего организма состоит из воды! В клетках происходит обмен веществ, и эти продукты обмена веществ имеют кислотные свойства, в то время как основная часть внутренних жидкостей, исключая желудочный сок, являются слабощелочными. Большую роль в этом играет состояние крови. Организм достаточно хорошо функционирует, когда кровь имеет слабощелочное состояние, с незначительным отклонением от pH 7.35 до 7.45.
Когда в крови и межклеточной жидкости содержится большое количество кислоты, возникает дисбаланс кислотности-щелочности. Даже небольшое отклонение от pH 7.35 до 7.45 может серьезно навредить здоровью. Когда процесс увеличения кислотности крови и понижения pH до 6.95 продолжается, возникает кома и риск для жизни существенно возрастает! Поэтому так важно контролировать pH питьевой воды, который является одним из важнейших показателей ее качества!
Определить уровень pH воды вы сможете сами дома. В качестве инструмента для измерения pH воды можно использовать индикаторную бумагу, которая изменяет свой цвет при погружении в исследуемую среду на короткое время. И так, индикаторная бумага при погружении в кислотную среду приобретает красный цвет, а при погружении в щелочную среду — синий цвет. Затем нужно сравнить получившийся цвет с цветной шкалой, где каждому оттенку соответствует определенное значение pH, чтобы определить уровень pH исследуемой жидкости. Этот метод определения pH является простым и дешевым.
Чтобы получить наиболее точные показатели pH, вы можете использовать pH-метр для воды. Он дороже лакмусовой бумаги, но позволяет определить уровень pH до сотых долей!
Для измерения pH воды используются бытовые (портативные) и лабораторные pH-метры. Обычно первый тип наиболее популярный, так что мы рассмотрим его подробнее. Они различаются:
Степенью защиты от воды.
Наличием или отсутствием автоматической калибровки.
Второй параметр определяется количеством точек калибровки (1 или 2). Точки — это буферные растворы, используемые для калибровки pH-метра. Мы рекомендуем приобрести прибор с автоматической калибровкой.
Есть специальные тест-полоски, которые определяют pH-уровень. Они очень удобны в использовании. Каждая упаковка этих полосок содержит шкалу, с помощью которой можно определить концентрацию водородных ионов. Однако такие полоски редко бывают доступны в продаже, и они довольно дорогостоящие.
Несмотря на все их преимущества, pH-метры для воды отличаются относительно высокой ценой.
Вы также можете использовать самодельные тест-полоски для определения pH воды.
На самом деле существует множество веществ, изменяющих цвет в зависимости от концентрации водородных ионов в жидкости. Например, если добавить каплю лимона в чай, он получит не желтый оттенок, а вместо коричневого станет желтым.
Аналогичным образом меняют цвет вишневый и смородиновый соки в зависимости от концентрации водородных ионов в них. В природе есть много органических индикаторов с такими свойствами. И на основе таких индикаторов создают домашние тест-полоски для измерения рН воды.
Мы воспользуемся пигментом антоцианином, который содержится в красной капусте. Этот пигмент относится к группе флавоноидов и отвечает за цветность сока капусты, изменяя его в зависимости от степени кислотности.
В кислой среде антоцианы окрашиваются в красный цвет, а в щелочной среде – в синий. В нейтральной среде они окрашиваются в фиолетовый цвет. Пигмент свеклы обладает аналогичными свойствами.
Для проведения эксперимента вам понадобится половина среднего качана красной капусты, его нужно мелко нарезать. Затем нарезанный овощ следует поместить в емкость и залить литром воды. Вскипятите воду и варите овощи в течение 20–30 минут.
В ходе варки часть жидкости испарится, и у вас получится насыщенный розовато-фиолетовый отвар. Остудите его и приготовьте основу для тестирования.
Отличным вариантом будет использование белой принтерной бумаги вместо специальных тест-полосок. Бумага не повлияет на цвет раствора и хорошо впитает пигменты. Ее нужно нарезать на полоски шириной примерно 1×5 см.
Перед определением рН воды необходимо пропитать бумажные полоски раствором антоцианина. Для этого отфильтруйте остывший отвар через марлю и погрузите бумагу в полученный раствор. Убедитесь, что полоски равномерно пропитались. Пропитывание должно продолжаться около 10 минут. В результате бумага приобретет бледно-сиреневый оттенок.
Затем полоски нужно высушить, разложив их на чистой бумаге или повесив на веревку.
Когда высохшая бумага, пропитанная отваром, будет готова, вы сможете приступить к измерению рН воды. Поместите несколько капель испытуемого раствора на бумажную полоску с помощью пипетки. Подождите несколько минут, чтобы пигмент взаимодействовал с бумагой. Цвет бумаги будет зависеть от рН воды. Сопоставьте полученный цвет с цветовой шкалой, чтобы узнать его значение.
Такой метод измерения рН очень простой в использовании. Для удобства можно разместить полоски в коробке или полиэтиленовом пакетике, чтобы защитить их от влаги.
Вы можете найти дополнительную информацию в источнике.